Stabile Isotope: neue Möglichkeiten der Analyse von Nahrungsnetzen
Forschungsbericht (importiert) 2005 - Max Planck Institut für Evolutionsbiologie
Interaktionen zwischen Organismen in aquatischen Ökosystemen spielen sich in so genannten „Nahrungsnetzen“ ab. Das sind Schemata, in denen die Fraß-und Konkurrenzbeziehungen der Organismen dargestellt werden. Solche Nahrungsnetze sind meistens sehr komplex. Deshalb ist es häufig schwer, die genaue Position und Funktion einer Art im Ökosystem zu bestimmen. Außerdem wechseln Organismen die von ihnen konsumierten Ressourcen je nach Angebot. Nur höhere Tiere haben einen Magen, in dem man feststellen kann, was sie vor kurzem konsumiert haben. Aber selbst wenn man Magenuntersuchungen durchführen kann, erhält man daraus immer nur einen Schnappschuss von einem bestimmten Zeitpunkt, keine Information über die durchschnittliche Ressourcennutzung.
Neue Methodik
Eine neue Methodik erlaubt nun, den Ressourcenkonsum von Organismen über längere Zeit zu mitteln und ihre Position im Nahrungsnetz zu bestimmen. Sie beruht darauf, dass für den Stoffwechsel der Organismen wichtige Elemente, zum Beispiel Kohlenstoff und Stickstoff, in der Natur in winzigen Mengen als ungewöhnliche, stabile Isotope vorliegen, d. h. mit einem vom normalen etwas abweichenden Atomgewicht. So kommt der Kohlenstoff, der normalerweise das Atomgewicht 12 hat (12C) auch mit dem Atomgewicht 13 (13C) vor, der Stickstoff liegt in Spuren als 15N statt des normalen 14N vor. In einem Massenspektrometer kann man das Verhältnis der Isotope eines Elements messen. In den biochemischen Prozessen im Stoffwechsel der Organismen werden nun die Isotope eines Elements nicht genau gleich verarbeitet. Zum Beispiel bleibt das schwerere Stickstoffisotop etwas länger in einer Zelle als das leichtere. Die Zelle wird also relativ an 15N zunehmen. Wenn diese Zelle von einem anderen Organismus gefressen wird, spielt sich wieder das Gleiche ab. Das bedeutet, dass mit jedem Schritt in der Nahrungskette das Verhältnis von 15N zu 14N größer (angereichert) wird. Misst man in biologischem Material das Verhältnis der beiden Isotope (in ‰), kann man dieses Verhältnis mit dem in einer weltweit akzeptierten Standardsubstanz vergleichen. Die Differenz ergibt einen charakteristischen Wert, den man als „Isotopensignatur“ (δ) des biologischen Materials bezeichnet, z. B. δ15N (‰).
Die Isotopensignatur hängt auch von der Herkunft der konsumierten Ressourcen ab. Zum Beispiel haben Landpflanzen, die bei der Photosynthese CO2 aus der Atmosphäre aufnehmen, ein höheres δ13C als Algen, die im Wasser Kohlensäure assimilieren. Deshalb haben Tiere in einem See, die in der Nähe des Ufers ins Wasser gefallene Blätter fressen, eine höhere Kohlenstoffsignatur als solche, die im Freiwasser Algen fressen. Ökologen benutzen die Kohlenstoffsignatur, um die Herkunft der Kohlenstoffquellen zu bestimmen [1], die Stickstoffsignatur, um die Position im Nahrungsnetz (die trophische Ebene) festzulegen. Jedes Mal, wenn biologische Substanz von einem anderen Organismus gefressen wird, also auf jeder Stufe der Nahrungskette, steigt das δ15N um circa 3 ‰ [2].
Spinnen leben von Methan
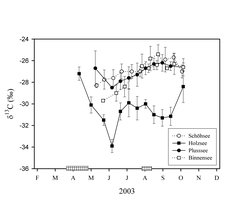
In der Abteilung Ökophysiologie am MPI für Limnologie hat die Anwendung von stabilen Isotopen zu überraschenden Ergebnissen geführt. Die Forscher waren überrascht, in Zuckmücken-Larven, die in der Tiefe von Seen unter sauerstoffarmen Bedingungen leben, ein extrem niedriges δ13C von circa –50 ‰ zu finden [3]. Das ist nur möglich, wenn die Tiere Methan, das im Seesediment entsteht, als Kohlenstoffquelle nutzen. Es zeigte sich, dass sie Methanbakterien fressen, die von der Oxidation des gebildeten Methans an der Grenze von sauerstofffreiem und sauerstoffhaltigem Wasser leben [4]. Nun schlüpfen diese Zuckmücken aber am Ende ihres Entwicklungszyklus und schwärmen über dem See. Dabei geraten sie in die Netze der Spinnen am Ufer. Die Folge ist, dass man das Methansignal auch in den Spinnen wiederfindet (Abb. 1). Wenn die Mücken geschlüpft sind, erniedrigt sich die 13C-Signatur in den Spinnen. Diese bekommen ca. 20 Prozent ihres Kohlenstoffbedarfs aus dem ursprünglichen Methan, ein Transportweg über die Wasseroberfläche hinaus, den niemand vermutet hatte. Allerdings besteht diese Verbindung nur, wenn in einem See viel Methan gebildet wird und Methanbakterien häufig sind.
Du bist, was du frisst
Eine andere Anwendung betrifft die Ökologie von Fischen, die für ihren Polymorphismus (die Existenz verschiedener morphologischer Typen) bekannt sind. Ein gutes Beispiel sind Fischarten der Gattung Coregonus, in Deutschland als Maränen, Felchen oder Renken bekannt. Coregonus lavaretus kommt vor allem in nordischen Seen häufig vor. Oft gibt es verschiedene Typen der gleichen Art, die sich in der Form des Maules und der Größe der Augen unterscheiden (Abb. 2).

Es gibt Hinweise darauf, dass sich diese Morphotypen in ihrem Habitat und in ihrer Nahrungsaufnahme unterscheiden. Die Analyse der stabilen Isotope unterstützt diese Hypothese. Die Morphotypen sind deutlich anhand ihrer 13C- und 15N-Signaturen zu differenzieren (Abb. 3). Diese spiegeln die Signaturen der Nahrungsorganismen in den verschiedenen Habitaten eines Sees wider. Allerdings liegen alle Stickstoff-Signaturen der Fische etwas höher als die der potenziellen Nahrungsorganismen, was zu erwarten war, da die Fische zu einer höheren trophischen Ebene gehören. Die Analyse macht also deutlich, dass die Fischtypen wahrscheinlich auf unterschiedliche Lebensräume und Nahrungsressourcen spezialisiert sind. Möglicherweise beobachtet man hier die Entstehung getrennter Arten [6]. Ähnliche Studien werden auch an anderen Fischen durchgeführt, zum Beispiel an Aalen [7].
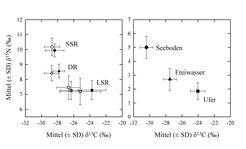


![Links: 15N- und 13C-Signaturen der drei Morphotypen von Coregonus lavaretus (siehe Abb. 2) in verschiedenen finnischen Seen. Die Morphotypen bilden charakteristische Gruppen. Rechts: Isotopen-Signaturen von Nahrungstieren der Fische in unterschiedlichen Lebensräumen eines Sees (Daten von [5]). Die Signaturen der Fisch-Morphotypen spiegeln die der Nahrungstiere wider, sind aber zu höheren δ15N-Werten verschoben. Links: 15N- und 13C-Signaturen der drei Morphotypen von Coregonus lavaretus (siehe Abb. 2) in verschiedenen finnischen Seen. Die Morphotypen bilden ch](https://www.mpg.de/397835/original-1293750063.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6Mzk3ODM1fQ%3D%3D--266f6d3ca5b176a72c7984541b99db29f4e02502)