Wann rasche Evolution eine Rolle spielt
Forschungsbericht (importiert) 2012 - Max Planck Institut für Evolutionsbiologie
Rasche Evolution
Eine der größten Entdeckungen von Charles Darwin war die Beobachtung, dass sich Individuen einer Art in Merkmalen unterscheiden, wie zum Beispiel in Größe oder Geschlecht, aber auch in Form oder Verhalten. Diese Unterschiede stellen das Material für natürliche Selektion dar und stehen somit im Mittelpunkt der evolutionsbiologischen Forschung. Allgemein wird angenommen, dass Änderungen von Merkmalen innerhalb einer Population nur sehr langsam (über hunderttausende von Generationen) auftreten, Evolution also ein langsamer Prozess ist. Aber in den letzten Jahren hat sich immer mehr gezeigt, dass sich evolutionäre Prozesse auch innerhalb von nur wenigen Generationen abspielen können [1]. Das hat nicht nur zur Folge, dass sich unsere Denkweise über Evolution ändern muss, sondern auch, dass Änderungen von Merkmalen so schnell ablaufen können, dass sie einen Einfluss auf ökologische Prozesse haben könnten.
Dieser auch als rasche Evolution oder Mikroevolution bezeichnete Prozess basiert, wie alle anderen evolutionären Prozesse auch, auf dem Vorhandensein von erblichen/vererbbaren Variationen von Merkmalen (Phänotypen) innerhalb einer Population und natürlicher Selektion. Innerartliche Variation kann zum Beispiel spontan durch Änderungen (Mutationen) des Erbguts entstehen. Da Mutationen sehr selten sind, spielt dieser Mechanismus vor allem für rasche Evolution in großen Populationen schnell wachsender Organismen eine Rolle (z. B. in Bakterienpopulationen, die innerhalb weniger Generationen Resistenzen gegen Antibiotika entwickeln).
Mikroevolution kann aber auch dann beobachtet werden, wenn Selektion unterschiedliche Kombinationen von Gen-Variationen (auch Allele genannt), die wiederum unterschiedliche Phänotypen hervorrufen, zu unterschiedlichen Zeitpunkten bevorzugt. Selektion arbeitet dann nicht an neuer innerartlicher Variation, sondern an sogenannter standing genetic variation. So haben Studien gezeigt, dass Leguane der Art Uta stansburiana innerhalb von wenigen Generationen unterschiedliche Reproduktionsstrategien evolvieren können, je nachdem wie groß der innerartliche Konkurrenzdruck ist [2]. Wenn nur wenige Artgenossen vorhanden sind, dann dominieren die Individuen mit den Genvarianten in der Population, die viele kleine Nachkommen produzieren. Wenn aber viele Artgenossen einen hohen Konkurrenzdruck ausüben, dann dominieren die Genvarianten in der Population, die nur wenige, dafür aber große Nachkommen haben. Diese Änderungen in der Frequenz von verschiedenen Genotypen, also Individuen mit unterschiedlichen Kombinationen von Allelen mit unterschiedlichen Merkmalausprägungen, haben auch unmittelbare Auswirkungen auf die Größe der Population. Viele kleine Nachkommen führen dazu, dass die Population schnell wächst, zu groß wird und die Ressourcen aufbraucht. Als Folge erhöht sich der Selektionsdruck durch innerartliche Konkurrenz und die Frequenz der Genotypen, die wenige große Nachkommen produzieren, nimmt zu. Dadurch nimmt das rapide Populationswachstum zwar ab, aber das reduzierte Populationswachstum kann nicht verhindern, dass die Population zusammenbricht. Dies führt dann wieder dazu, dass die Genotypen bevorzugt werden, die viele kleine Nachkommen produzieren, und ein neuer Zyklus beginnt. Die Änderung des Selektionsdrucks, entweder für viele kleine oder wenige große Nachkommen, geht also Hand in Hand mit Änderungen der Populationsgröße. Damit wird deutlich, dass evolutionäre und populations-ökologische Dynamiken unmittelbar miteinander verknüpft sein können und man diese nicht unabhängig voneinander betrachten kann. Dieser Prozess wird allgemein als öko-evolutionäre Schleife bezeichnet (oder: eco-evolutionary feedback) [3].
Warum ist rasche Evolution wichtig?
Die Erkenntnis, dass Individuen einer Population nicht alle gleich sind, sondern sich in Merkmalen wie zum Beispiel der Anzahl und Größe von Nachkommen unterscheiden, ist für die Evolutionsbiologie natürlich nicht neu. Aber erst in den letzten Jahren ist durch die Entdeckung der Wichtigkeit von öko-evolutionären Feedback-Dynamiken deutlich geworden, dass Variationen innerhalb von Populationen und Mikroevolution auch von großer Bedeutung für ökologische und andere evolutionäre Prozesse sein können. Zum einen kann das Zusammenspiel von ökologischen und evolutionären Prozessen einen entscheidenden Einfluss auf die Stabilität von Artengemeinschaften haben. Zum anderen erlauben öko-evolutionäre Feedback-Dynamiken, dass innerartliche Variationen erhalten bleiben [4]. Ohne das Zusammenspiel von Selektion und Populationswachstum im Beispiel der Leguane würde einer der beiden Phänotypen verschwinden. Damit gibt es nicht nur ein Interesse seitens der Grundlagenforschung, sondern auch aus dem Bereich des Naturschutzes und -Managements, da hier Stabilität und die Erhaltung von innerartlicher Variation von großer Bedeutung sind. Wir wissen aber noch sehr wenig darüber, welche Auswirkungen diese Erkenntnis auf unser Verständnis von ökologischen und evolutionären Prozessen hat. Das Phänomen öko-evolutionärer Feedback-Dynamiken und die Bedeutung von Mikroevolution untersuchen Lutz Becks und seine Kollegen und Kolleginnen am Max-Planck-Institut für Evolutionsbiologie im Detail mittels planktischer Systeme, der Analyse mathematischer Modelle und genomischer Analysen.
Das Modellsystem
Um die Bedeutung des Zusammenspiels von rascher Evolution und Populationsdynamiken zu untersuchen, nutzt die Arbeitsgruppe einfache Laborsysteme, die wichtige Bestandteile von Nahrungsnetzen widerspiegeln. Wichtig für ein solches System ist, dass die Organismen sich schnell vermehren, da es trotz rascher Evolution nötig ist, viele Generationen in relativ kurzer Zeit zu betrachten. Es ist aber auch wichtig, dass man Änderungen in den Populationsgrößen und Merkmalausprägungen innerhalb einer Population verfolgen kann. Ein solches Modell ist zum Beispiel ein Rädertier-Algen-System, das genutzt wird, um öko-evolutionäre Feedback-Dynamiken in Räuber-Beute-Systemen zu untersuchen [4, 5]. Rädertiere sind mehrzellige Planktontiere (Abb. 1), die in allen Gewässern weltweit vorkommen. Die hier verwendeten Tiere der Art Brachionus calyciflorus pflanzen sich obligat ungeschlechtlich fort und haben eine Generationszeit von weniger als zwei Tagen. Die verwendeten Algen der Art Chlamydomonas rheinhardtii gehören zu den Grünalgen und diese können sich mehr als einmal am Tag teilen.
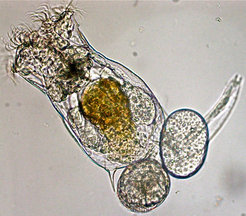
Abb. 1: Rädertier der Art Brachionus calyciflorus mit zwei durch Jungfernzeugung (Parthenogenese) produzierten Eiern.
Algen und Rädertiere können in Durchflusssytemen, sogenannten Chemostaten (Abb. 2), über mehrere Wochen und damit Dutzenden von Generationen unter konstanten Laborbedingungen zusammen kultiviert werden. Während dieser Zeit kann man dann sowohl Änderungen der Populationsdichten (die ökologische Dynamik) als auch Änderungen von Merkmalen innerhalb von Populationen (die evolutionäre Dynamik) beobachten.
Wie zuvor beschrieben, müssen sich die Individuen innerhalb einer Population für Mikroevolution und öko-evolutionäre Feedback-Dynamiken in mindestens einem entscheidenden Merkmal unterscheiden. Diese innerartliche Variation kann in der Algenpopulation zum einen durch Mutationen entstehen, zum anderen stehen Stammkulturen verschiedener Genotypen mit unterschiedlichen Merkmalsausprägungen zur Verfügung. Sie erlauben es, die innerartliche Variation in der Beutepopulation zu Beginn eines Versuches zu manipulieren (standing genetic variation). Wenn Chlamydomonas zusammen mit den Rädertieren für Dutzende von Generationen unter konstanten Laborbedingungen (Abb. 2) wächst, kann man beobachten, dass die Algen nach vielen Generationen einen Fraßschutz entwickeln [4]. Die eigentlich einzelligen Algen wachsen dann als Kolonien, die von den Rädertieren nicht mehr gefressen werden können. Wie im Beispiel der Leguane hat die Evolution eines neuen Merkmals (hier der Fraßschutz) auch einen Einfluss auf populations-ökologische Dynamiken. Die Rädertiere und die Algen zeigen typische Räuber-Beute-Zyklen, solange einzellige fraßungeschützte Algen die Population dominieren. Wenn aber nach zwei bis drei Räuber-Beute-Zyklen die fraßgeschützten Algen durch Selektion bevorzugt werden und somit die Population dominieren, wechselt das System von den Räuber-Beute-Zyklen in ein stabiles Gleichgewicht.

Abb. 2: Chemostatensystem, das benutzt wird, um öko-evolutionäre Dynamiken in Planktongemeinschaften zu untersuchen.
Einen ähnlich großen Einfluss auf die Populationsdynamiken kann man beobachten, wenn man die genetische Variation innerhalb der Algenpopulation zu Beginn des Experiments manipuliert [4, 5]. Wenn man zum Beispiel Rädertiere nicht mit einem Genotypen wie im obigen Beispiel, sondern zusammen mit einem Chlamydomonas-Genotypen, der einzellig wächst, und einem Chlamydomonas-Genotypen, der in sehr großen Kolonien wächst, in die Chemostaten gibt, kann man Folgendes beobachten. Ähnlich wie im Beispiel der Leguane ändert sich der Selektionsdruck auf die Algenpopulation innerhalb von wenigen Generationen. Wenn nur wenige Rädertiere vorhanden sind und somit der Fraßdruck auf die Algen niedrig ist, werden die schnell wachsenden fraßungeschützten Genotypen bevorzugt (einzellige Algen). Die Rädertiere nutzen das große Nahrungsangebot und die Rädertierpopulation wächst schnell zu großen Dichten heran. Dadurch erhöht sich aber auch der Fraßdruck auf die Algen und die fraßgeschützten Genotypen der Algen (koloniebildende Algen) werden bevorzugt. Viele fraßgeschützte Algen in der Population führen aber dazu, dass die Bedingungen für das Wachstum der Rädertiere schlechter werden, was zur Folge hat, dass die Rädertierpopulation langsam zusammenbricht. Wenn wieder nur wenige Rädertiere vorhanden sind, wechselt die Richtung des Selektionsdrucks wieder und die schneller wachsenden Algen ohne Fraßschutz haben einen Vorteil und nehmen in der Frequenz und Anzahl wieder zu (Abb. 3). Diese komplette öko-evolutionäre Schleife kann dann wieder von vorne beginnen.
In diesem Beispiel bewirkt die Änderung des Fraßdrucks auf die Algen, dass mal die fraßgeschützten, mal die fraßungeschützten Varianten bevorzugt werden, wobei der Wechsel der beiden Varianten selber die Änderung des Fraß- und Selektionsdrucks verursacht. Als Resultat dieser öko-evolutionären Schleife beobachtet man Dynamiken, die man ohne Mikroevolution in der Beute nicht finden würde. So sind die beobachteten Räuber-Beute-Zyklen viel länger als typische Räuber-Zyklen; Räuber und Beute zeigen ungewöhnliche Antizyklen (Abb. 3). Ähnlich wie im Beispiel der Leguane führt aber das Zusammenspiel von Mikroevolution und Populationsdynamiken auch dazu, dass die Variation innerhalb der Populationen (der fraßgeschützte und ungeschützte Genotyp) nicht verloren geht.
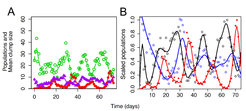
Abb. 3: A) Öko-evolutionäre Dynamiken in Rädertier-Algen-Systemen (Räuber-Beute-Systemen), wenn das System mit innerartlicher Variation gestartet wird (Rädertier B. calyciflorus: rote Linie; Grünalge C. rheinhardtii: grüne Linie; als entscheidendes Merkmal der Beutepopulation ist die mittlere Koloniegröße angegeben: Je größer die mittlere Koloniegröße ist, desto mehr Algen mit Fraßschutz sind in der Population vorhanden; lila Linie). Das Zusammenspiel von Populationsdynamiken und Änderungen des Selektionsdrucks, mal für fraßgeschützte und mal für schneller wachsende ungeschützte Algen, führt zu ungewöhnlich langen und antizyklischen Dynamiken in der Räuber-Beute-Artengemeinschaft.
B) Wenn man die Details betrachtet, erkennt man, dass eine steigende Räuberdichte (rote Linie) zu einer Selektion von fraßgeschützten Algen führt (schwarze Linie). Der Anstieg in fraßgeschützten Algen hat wiederum zur Folge, dass die wachsende Rädertierpopulation nicht mehr ausreichend Nahrung findet. Wenn nur noch wenige Rädertiere vorhanden sind und der Fraßdruck auf die Algenpopulation gering ist, werden wieder die schneller wachsenden, aber fressbaren Algen bevorzugt (blaue Linie). Nun ist wieder ausreichend gute Nahrung für den Räuber vorhanden und die Rädertierpopulation nimmt wieder zu, der Zyklus beginnt von vorne.
Wann und wo spielt rasche Evolution noch eine Rolle?
Die Beobachtung, dass öko-evolutionäre Feedback-Dynamiken sowohl für die Stabilität als auch für die Erhaltung der innerartlichen Variation von Bedeutung sind, macht dieses Zusammenspiel sehr wichtig für andere ökologische und evolutionäre Prozesse. Eine entscheidende, noch unbeantwortete Frage ist, wie häufig diese Feedbacks zu finden sind [1]. Zur Beantwortung dieser Frage könnte man verschiedene Interaktionen betrachten und untersuchen, ob es das enge Zusammenspiel von ökologischen und evolutionären Prozessen auch in unterschiedlichen und größeren Nahrungsnetzen gibt und welche Konsequenzen es für die populations-ökologischen Dynamiken und die innerartliche Variation hat. Um diesen Fragen nachzugehen, kombiniert die Arbeitsgruppe um Lutz Becks Laborversuche in Chemostatsystemen (Abb. 2) mit der Analyse von mathematischen Modellen. Eine Studie mit einem zusätzlichen Räuber hat gezeigt, dass auch in größeren Artengemeinschaften diese öko-evolutionären Feedback-Dynamiken sowohl für die populations-ökologischen Änderungen als auch für die innerartliche Variation eine entscheidende Rolle spielen [6].
Ein derzeitig laufendes Projekt beschäftigt sich mit öko-evolutionären Feedback-Dynamiken in einem System, in dem die Beute eines Räubers gleichzeitig der Wirt eines Parasiten ist. Damit konkurrieren Räuber und Parasit um die gleiche Ressource. Es ist zu erwarten, dass sich Verteidigungsmechanismen gegen Räuber und Parasiten unterscheiden und damit unterschiedliche Phänotypen evolvieren werden. Unter anderem sollen folgende Fragen beantwortet werden: Wie wird die Koevolution von Wirt und Parasit durch die Anwesenheit des Räubers beeinflusst? Gibt es auch in diesem System das Zusammenspiel von rascher Evolution und Populationsdynamiken, auch wenn die Dynamiken von Räuber und Parasit unterschiedliche Selektionsdrücke ausüben?
Das relativ einfache Laborsystem bietet noch weitere interessante Möglichkeiten, Dynamiken auf verschiedenen Ebenen und Skalen miteinander zu verknüpfen. Da die Dynamiken der einzelnen Populationen und Phänotypen (z. B. fressbar und nichtfressbar) bekannt sind, kann das System auch genutzt werden, diese Dynamiken mit Änderungen auf der Genom- und Transkriptom-Ebene zu verknüpfen. Damit hofft die Arbeitsgruppe „Dynamiken von Artengemeinschaften“ einen besseren Einblick in Adaptationsmechanismen zu erhalten. Eine wichtige Frage hierbei ist, ob Änderungen in einigen wenigen Genen ausreichend sind, um einen fraßgeschützten Phänotypen zu erhalten, oder ob viele Änderungen notwendig sind.


