Die Koevolution zwischen Wirt und Darmbakterien
Forschungsbericht (importiert) 2010 - Max Planck Institut für Evolutionsbiologie
Die Mikrobiota im Darm
Die Forschung des letzten Jahrzehnts in mehreren biomedizinischen Bereichen hat unser Bewusstsein daraufhin geschärft, den menschlichen Körper als „wandelndes Ökosystem“ wahrzunehmen. Unser Darmsystem, die Mundhöhle und die Haut besitzen eine überwältigend große Anzahl verschiedener Mikroorganismen, bezeichnet als „Mikrobiota“ [1]. Insbesondere das menschliche Darmsystem eines Erwachsenen weist eine atemberaubende Zahl an Bakterien auf, nämlich bis zu 100 Billionen. Dies ist in etwa das 10-fache unserer eigenen Körperzellen [2]. Diese komplexen Ansammlungen von Bakterien, die unseren Darm bevölkern, sind für zahlreiche physiologische Abläufe im Wirt erforderlich, so zum Beispiel für die Synthese von Vitaminen, den Abbau von nicht verdaulichen Pflanzenpolysacchariden oder die Abwehr von Krankheitserregern. Zudem tragen sie zur korrekten Entwicklung des Darmgewebes und des Immunsystems bei. Aufgrund dieser vielfältigen Funktionen wird die Mikrobiota manchmal auch als „vergessenes Organ“ bezeichnet [3]. Viele ihrer Mitglieder bilden stabile, interaktive Verbände mit ihrem Wirt und werden daher auch als Kommensalen oder Symbionten bezeichnet. Obwohl bekannt ist, dass die Darmbakterien eine wichtige Rolle für die Physiologie des Wirtes spielen, stellt der Erhalt dieser wechselseitigen Beziehung eine große Herausforderung für den Wirt dar. So muss das Immunsystem beispielsweise sowohl tolerant gegenüber „Freunden“ bleiben, gleichzeitig aber effektiv gegen „Feinde“, sogenannte Pathogene, vorgehen. In Individuen mit chronisch-entzündlichen Darmerkrankungen (engl.: inflammatory bowel disease, IBD) zeigt sich etwa, dass ein Verlust der Toleranz gegenüber Antigenen der Darm-Mikrobiota zusammen mit dem Versagen der Barrierefunktion der Darmwand mit einer chronisch-entzündlichen Reaktion auf diese „Symbionten“ verbunden ist. Die Mikrobiota spielt also eine herausragende Rolle sowohl im gesunden Zustand des Darms als auch bei chronisch entzündlichen Krankheiten wie den IBDs. Dabei sind einige genetische Varianten, die zu einer erhöhten Anfälligkeit für IBD führen, durch evolutionären Selektionsdruck (z.B. Pathogenresistenz) entstanden. Daher erforscht die Arbeitsgruppe um John Baines im Rahmen des DFG-Exzellenzclusters “Inflammation at Interfaces“ schwerpunktmäßig die Evolution und genetische Grundlagen der Wechselwirkungen zwischen Säugetier-Wirten und ihrer Mikrobiota.
Bakterielle Metagenomik
Die Bakteriengemeinschaften, die den menschlichen Darm bewohnen, bestehen aus schätzungsweise 500 bis 1.000 Arten. Eine Kultivierung von ungefähr der Hälfte der Arten ist bisher mit traditionellen mikrobiologischen Techniken nicht möglich [4]. Jedoch stellt sich das schnell wachsende Feld der Metagenomik diesem Problem und ermöglicht das Studium des genetischen Materials genau dieser Bakterien. Metagenomik ist ein Forschungsgebiet der Biowissenschaften, das mit modernen molekularbiologischen Methoden die Gesamtheit der Mikroorganismen eines Biotops zu erfassen versucht. Das Material kann direkt aus seiner natürlichen Umgebung gewonnen werden, Koloniebildungen sind nicht mehr nötig. Dies wurde durch die Reduzierung der Sequenzierungskosten und insbesondere durch das Aufkommen des „Next Generation Sequencing“, also neuen Sequenzierungstechnologien, möglich. Der bei weitem vielseitigste und meist genutzte genetische Marker für die Identifizierung von Bakterien auf dem Niveau von Sequenzen ist die kleine Untereinheit des ribosomalen RNA (rRNA)-Gens (16S-rRNA in Bakterien und Archaeen und 18S-rRNA in Eukaryoten). Die Polymerase-Kettenreaktion (engl.: polymerase chain reaction, PCR) stellt die Grundlage der Sequenzierung dar, mit der bestimmte Regionen des Genoms vervielfältigt werden können. Diese Regionen können sowohl für Sequenzen größerer Gruppen (so wie die aller Bakterien) als auch spezifischer für kleinere Gruppen (wie z.B. die des einzigen Mitglieds der Gattung Lactobacillus) bestimmt werden. Diese allgemeine oder spezifische Definition der zu sequenzierenden Regionen wird erst durch die einzigartige Evolution der RNA-Sequenz ermöglicht.
Die Rolle der Blutgruppenantigene im Darmsystem
Seit der Entdeckung des AB0-Blutgruppensystems von Karl Landsteiner im Jahr 1900 spielen Blutgruppen eine wichtige und vielseitige Rolle in der Biomedizin. Blutgruppensysteme werden bestimmt durch die An- oder Abwesenheit von Wirtsproteinen oder Kohlenstoffwassermolekülen, die durch das Immunsystem erkannt werden können (sogenannte Blutgruppenantigene). Viele dieser Gene, die Blutgruppenantigene kodieren, gehören zu den Glykosyltransferasen. Diese fügen Zuckermoleküle zu anderen Zuckern, Proteinen oder Fetten hinzu.
Blutgruppensysteme sind hauptsächlich für ihre Rolle in der Transfusionsmedizin und Immunologie bekannt. Auch sind einige Glykosyltransferasen, die bei der Synthese von Blutgruppen eine Rolle spielen, in der Darmwand aktiv. In diesem Fall fungieren die von den Enzymen produzierten Zuckermoleküle als Bindungsstellen oder auch als Nahrungsquellen für Mitglieder der Mikrobiota [4-5]. Die An- oder Abwesenheit von Zuckermolekülen im Magen-Darm-Trakt beeinflusst unter anderem die Abwehr von Pathogenen und die Anfälligkeit für Krankheiten wie Morbus Crohn, eine der zwei bekanntesten Formen von chronisch-entzündlichen Darmerkrankungen [6].
Die Evolution des Gens B4galnt2 und sein Einfluss auf die Mikrobiota im Darm
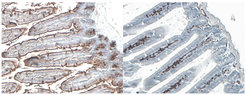
Eines der laufenden Projekte in der Forschungsgruppe Baines konzentriert sich auf das mit einer Blutgruppe in Zusammenhang stehende Gen B4galnt2. Das von B4galnt2 kodierte Enzym findet man bei den meisten Säugetieren, den Menschen eingeschlossen, im Epithel des Darms. Ein erstaunliches Phänomen diesbezüglich zeigt sich in Hausmäusen. Alternative Formen des Gens, bezeichnet als „Allele“, führen zu Unterschieden, in welchen Geweben das Gen exprimiert (angeschaltet) wird. Das “normale“ Allel (üblicherweise als “Wildtyp“ bezeichnet) wird im Magen-Darm-Trakt exprimiert, das alternative Allel hingegen (bezeichnet als “Mutant“) in den Wänden der Blutgefäße (Abb. 1).
Aus noch ungeklärten Gründen weisen Mäuse, welche eine Kopie des mutanten Allels besitzen, eine Art Bluterkrankheit auf, die der Von-Willebrand-Krankheit beim Menschen ähnelt. Das Muster, das die DNA-Sequenz in der das Gen umgebenden Region aufweist, gibt Hinweise darauf, dass die verschiedenen Allele schon über mehrere Millionen Jahre in Hausmäusen konserviert sind [7]. Dies wiederum lässt vermuten, dass entweder der Gewinn der Expression des Gens in den Blutgefäßwänden und/oder der Verlust der Expression im Magen-Darm-Trakt unter bestimmten Umständen einen Nutzen für die Mäuse darstellt, z.B. bei dem Ausbruch einer Infektion. Andernfalls würden die Nebeneffekte des mutanten Allels (z.B. verlängerte Blutungszeit) dafür sorgen, dass dieses Allel aus der Population verschwindet.
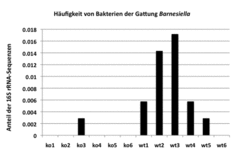
Um den Einfluss der An-/Abwesenheit der Zucker von B4galnt2 im Darmtrakt der Hausmaus auf die Mikrobiota zu erforschen, arbeiten Mitglieder der Arbeitsgemeinschaft Baines mit Jill Johnsen vom Puget Sound Blood Center in Seattle, Washington, USA, zusammen. Metagenomische Techniken, wie das „massive parallel pyrosequencing“ der bakteriellen 16S-rRNA, werden angewandt, um die Bakteriengemeinschaften zu bestimmen. Hiermit kann zwischen Mäusen mit dem Wildtyp-Allel (Darmexpression) und Mäusen, die ein nicht-funktionales Allel haben (bezeichnet als „knock-out“ für B4galnt2) unterschieden werden. Die Ergebnisse deuten darauf hin, dass der Verlust der Genexpression im Darm die Bakteriengemeinschaft signifikant verändert. Einige Bakterienarten sind davon betroffen, z.B. ein noch zu beschreibendes Mitglied der Gattung Barnesiella (Abb. 2). Zukünftige Experimente sollen helfen die Konsequenzen zu ermitteln, die Unterschiede in der Zusammenstellung der Bakteriengemeinschaft auf die Fitness des Wirts haben können.

